質問番号 2020-0057 で「なぜ鉄は“サビ”るのか」について説明していただきましたが、「腐食の原理」について、もう少し詳しく教えて下さい。 また、その説明資料がありましたら紹介して下さい。
このQ&Aは完了しましたのでクローズします
Kameda Kazuyuki Changed status to publish
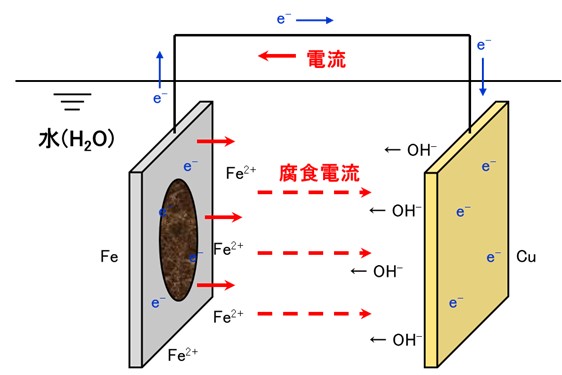
下図は、水の中に鉄(Fe)と銅(Cu)を浸漬させて電線で電気的に接続したイメージ図です。
この時、イオン化傾向の高いFeがイオン化(Fe2+)して鉄の表面に溶出し、金属内部に電子を残します(酸化反応)。この電子が電線を通ってCu側へ移動します。Cu表面では移動してきた電子を水中の溶存酸素や水が受け取って水酸化物イオン(OH-)を生成します(還元反応)。OH-は水中を移動してFe側に到達して、Fe表面のFe2+と結合してFe(OH2)(サビ)となります。
電子がFe側からCu側に移動するため、その逆方向に電流が流れます。水中ではFe側からCu側に電流(腐食電流)が流れます。
上記の電気化学反応を式で示すと以下のようになります。
酸化反応: Fe → Fe2+ + 2e-
還元反応: H2O + 1/2O2 + 2e- → 2OH-
Fe + H2O + 1/2O2 → Fe(OH)2 (サビ)
上記式より、鉄は水と酸素が存在する環境でサビが生じることが分かります。
詳細は、弊社HPのプレゼン資料「腐食と電気防食」を御参照下さい。
URL:http://www.nakabohtec.co.jp/presentation/pdf/presentation01.pdf
(株式会社ナカボーテック 久野記)
Kameda Kazuyuki Edited answer